

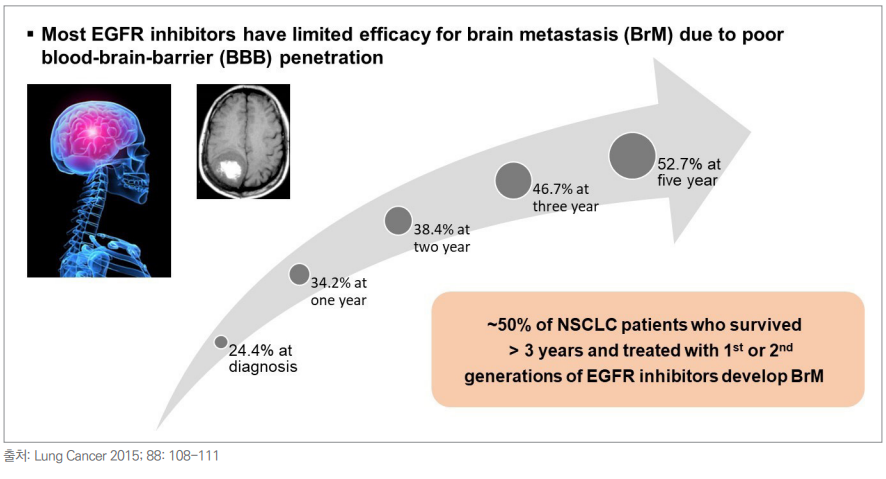

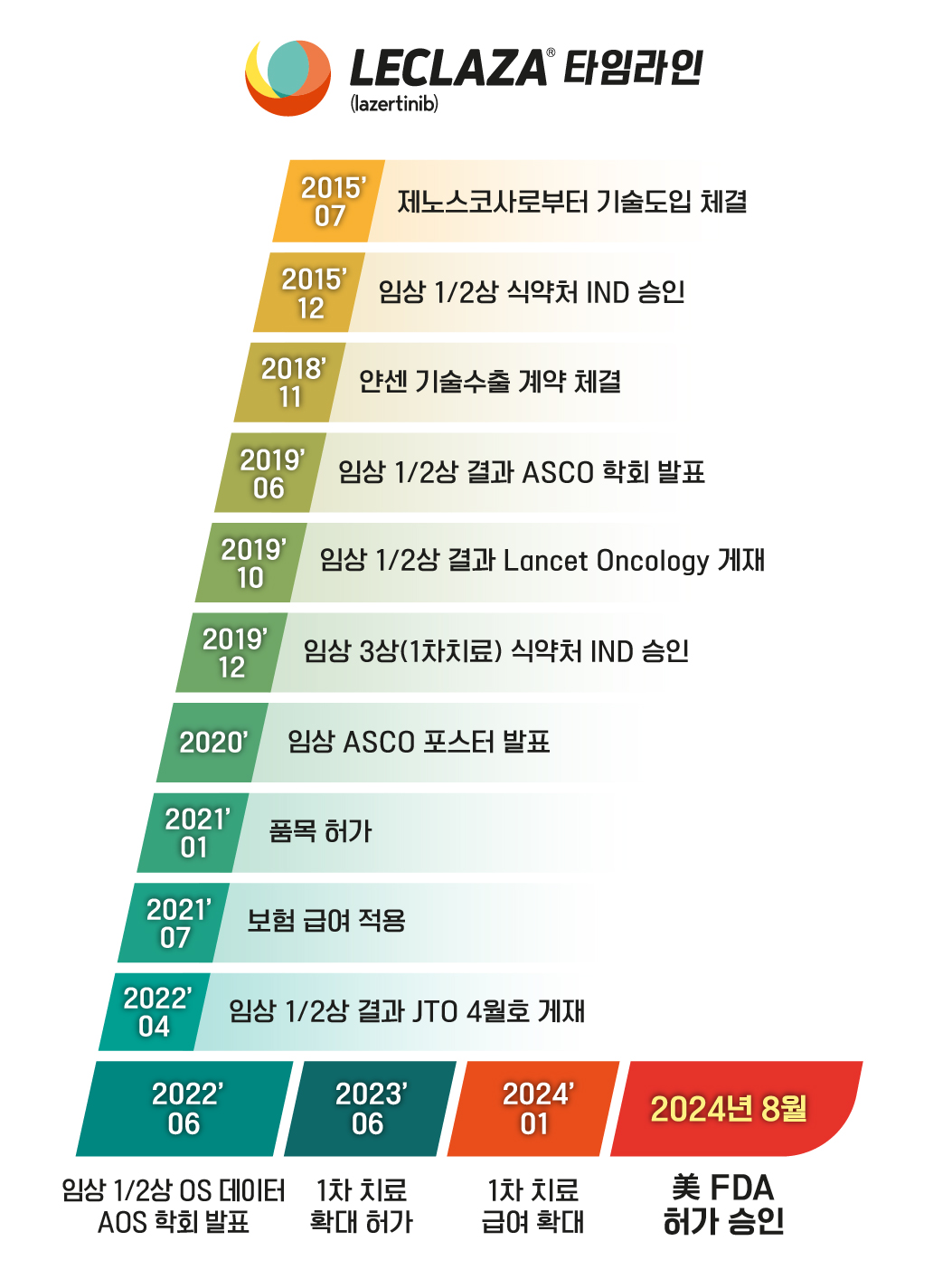

댓글 운영방식은
댓글은 실명게재와 익명게재 방식이 있으며, 실명은 이름과 아이디가 노출됩니다. 익명은 필명으로 등록 가능하며, 대댓글은 익명으로 등록 가능합니다.
댓글 노출방식은
새로운 댓글을 올리는 일반회원은 댓글의 하단에 실시간 노출됩니다.
댓글의 삭제 기준은
다음의 경우 사전 통보없이 삭제하고 아이디 이용정지 또는 영구 가입제한이 될 수도 있습니다.
저작권·인격권 등 타인의 권리를 침해하는 경우
상용 프로그램의 등록과 게재, 배포를 안내하는 게시물
타인 또는 제3자의 저작권 및 기타 권리를 침해한 내용을 담은 게시물
근거 없는 비방·명예를 훼손하는 게시물
특정 이용자 및 개인에 대한 인신 공격적인 내용의 글 및 직접적인 욕설이 사용된 경우
특정 지역 및 종교간의 감정대립을 조장하는 내용
사실 확인이 안된 소문을 유포 시키는 경우
욕설과 비어, 속어를 담은 내용
정당법 및 공직선거법, 관계 법령에 저촉되는 경우(선관위 요청 시 즉시 삭제)
특정 지역이나 단체를 비하하는 경우
특정인의 명예를 훼손하여 해당인이 삭제를 요청하는 경우
특정인의 개인정보(주민등록번호, 전화, 상세주소 등)를 무단으로 게시하는 경우
타인의 ID 혹은 닉네임을 도용하는 경우
게시판 특성상 제한되는 내용
서비스 주제와 맞지 않는 내용의 글을 게재한 경우
동일 내용의 연속 게재 및 여러 기사에 중복 게재한 경우
부분적으로 변경하여 반복 게재하는 경우도 포함
제목과 관련 없는 내용의 게시물, 제목과 본문이 무관한 경우
돈벌기 및 직·간접 상업적 목적의 내용이 포함된 게시물
게시물 읽기 유도 등을 위해 내용과 무관한 제목을 사용한 경우
수사기관 등의 공식적인 요청이 있는 경우
기타사항
각 서비스의 필요성에 따라 미리 공지한 경우
기타 법률에 저촉되는 정보 게재를 목적으로 할 경우
기타 원만한 운영을 위해 운영자가 필요하다고 판단되는 내용
사실 관계 확인 후 삭제
저작권자로부터 허락받지 않은 내용을 무단 게재, 복제, 배포하는 경우
타인의 초상권을 침해하거나 개인정보를 유출하는 경우
당사에 제공한 이용자의 정보가 허위인 경우 (타인의 ID, 비밀번호 도용 등)
※이상의 내용중 일부 사항에 적용될 경우 이용약관 및 관련 법률에 의해 제재를 받으실 수도 있으며, 민·형사상 처벌을 받을 수도 있습니다.
※위에 명시되지 않은 내용이더라도 불법적인 내용으로 판단되거나 데일리팜 서비스에 바람직하지 않다고 판단되는 경우는 선 조치 이후 본 관리 기준을 수정 공시하겠습니다.
※기타 문의 사항은 데일리팜 운영자에게 연락주십시오. 메일 주소는 dailypharm@dailypharm.com입니다.
| 약국 일반약 매출액 Top 100 (전월기준) | ||||
| 순위 | 상품명 | 횟수 | ||
| 1 | 타이레놀정500mg(10정) | 26980 | ||
| 2 | 까스활명수큐액 | 12932 | ||
| 3 | 케토톱플라스타(40매) | 5258 | ||
| 4 | 아로나민골드프리미엄정(120정) | 1344 | ||
| 5 | 애크논크림 | 5297 | ||
| 6 | 판콜에스내복액 | 9809 | ||
| 7 | 판피린큐액 | 7950 | ||
| 8 | 리쥬비넥스크림 | 974 | ||
| 9 | 노스카나겔 20g | 2197 | ||
| 10 | 타이레놀정500mg(30정) | 5008 | ||
| 11 | 잇치페이스트치약120g | 3192 | ||
| 12 | 애크린겔 | 3523 | ||
| 13 | 벤포벨S에스정 | 768 | ||
| 14 | 멜라토닝크림 | 1837 | ||
| 15 | 맥스콘드로이틴1200 | 296 | ||
| 16 | 텐텐츄정(120정) | 1575 | ||
| 17 | 탁센 연질캡슐(10캡슐) | 10173 | ||
| 18 | 베나치오에프액75ml | 7951 | ||
| 19 | 이가탄에프캡슐(60캡슐*3) | 1195 | ||
| 20 | 둘코락스-에스장용정(40정) | 2021 | ||
| 21 | 지르텍정 | 5588 | ||
| 22 | 비판텐연고 30g | 2612 | ||
| 23 | 후시딘연고10g | 3919 | ||
| 24 | 신신파스아렉스 대형 | 3810 | ||
| 25 | 텐텐츄정(10정) | 10341 | ||
| 26 | 탁센 연질캡슐(30캡슐) | 3421 | ||
| 27 | 이지엔6이브연질캡슐(30캡슐) | 3422 | ||
| 28 | 광동우황청심원현탁액50ml(사향,변방) | 1140 | ||
| 29 | 케펨플라스타 | 4090 | ||
| 30 | 광동경옥고 | 272 | ||
| 31 | 아로나민골드정(100정) | 797 | ||
| 32 | 광동우황청심원현탁액50ml(영묘향) | 1597 | ||
| 33 | 후시딘연고5g | 4502 | ||
| 34 | 동아D-판테놀연고 | 2379 | ||
| 35 | 잇치페이스트피톤치드 | 1528 | ||
| 36 | 게보린정(10정) | 4954 | ||
| 37 | 투엑스비트리플정 | 386 | ||
| 38 | 마데카솔케어연고10g | 3313 | ||
| 39 | 콜대원 코프큐시럽 | 5117 | ||
| 40 | 광동우황청심원환(사향) | 286 | ||
| 41 | 백초시럽플러스 | 3486 | ||
| 42 | 프렌즈아이드롭점안액쿨하이 업 | 3653 | ||
| 43 | 오큐시스점안액0.5ml*60개 | 1236 | ||
| 44 | 인사돌플러스(100정) | 662 | ||
| 45 | 머시론정 | 1931 | ||
| 46 | 프렌즈아이드롭점안액쿨 업 | 3529 | ||
| 47 | 센시아(180정) | 284 | ||
| 48 | 메이킨큐장용정(40정) | 1757 | ||
| 49 | 비맥스메타비정 | 355 | ||
| 50 | 센시아정(120정) | 361 | ||
| 51 | 유한비타민C정1000mg | 1050 | ||
| 52 | 신신파스아렉스 중형 | 3742 | ||
| 53 | 프렌즈아이드롭점안액순 업 | 3134 | ||
| 54 | 챔프시럽 | 3359 | ||
| 55 | 잇치 프로폴리스 | 1106 | ||
| 56 | 비맥스제트정(100정) | 308 | ||
| 57 | 로게인폼60g(3개) | 222 | ||
| 58 | 리안점안액 | 947 | ||
| 59 | 용표우황청심원액 50ml(무스콘,변방) | 1185 | ||
| 60 | 안티푸라민 더블파워 대형 | 2367 | ||
| 61 | 마데카솔케어연고 6g | 3460 | ||
| 62 | 아젤리아크림30g | 665 | ||
| 63 | 마그비맥스연질캡슐 | 342 | ||
| 64 | 인사돌플러스정(270정) | 230 | ||
| 65 | 이지엔6이브연질캡슐(10캡슐) | 5073 | ||
| 66 | 겔포스엘현탁액(6포) | 2360 | ||
| 67 | 광동원탕 | 4114 | ||
| 68 | 노스카나겔10g | 1343 | ||
| 69 | 타이레놀8시간이알서방정 | 4047 | ||
| 70 | 코메키나캡슐 | 2967 | ||
| 71 | 오트리빈멘톨0.1%분무제 | 1246 | ||
| 72 | 인사돌정(100정) | 529 | ||
| 73 | 디펜쿨플라스타(10매) | 2444 | ||
| 74 | 니코레트껌 2mg(30개입) | 833 | ||
| 75 | 크린클멸균생리식염수20ml*20앰플 | 1382 | ||
| 76 | 안티푸라민 더블파워 중형 | 2372 | ||
| 77 | 조아팝(10매) | 1943 | ||
| 78 | 로토씨큐브 아쿠아차지 | 2436 | ||
| 79 | 모드콜에스연질캡슐(10캡슐) | 3776 | ||
| 80 | 마그비스피드액 | 1343 | ||
| 81 | 탁센레이디연질캡슐(10캡슐) | 3437 | ||
| 82 | 이지엔6프로연질캡슐(30캡슐) | 1742 | ||
| 83 | 코앤쿨 나잘스프레이 | 1323 | ||
| 84 | 용표우황청심원액50ml(사향,변방) | 742 | ||
| 85 | 클리어틴 | 1178 | ||
| 86 | 타이레놀콜드에스정 | 3165 | ||
| 87 | 판시딜캡슐(270캡슐) | 138 | ||
| 88 | 콜대원콜드큐시럽 | 3166 | ||
| 89 | 세비타비겔 | 1114 | ||
| 90 | 대웅우루사연질캡슐(120캡슐) | 351 | ||
| 91 | 마그비스피드 더블액션 | 974 | ||
| 92 | 소하자임플러스정 | 3960 | ||
| 93 | 도미나크림60g | 278 | ||
| 94 | 콜대원 노즈큐에스시럽 | 3071 | ||
| 95 | 굿모닝에스과립 | 1427 | ||
| 96 | 멜리안정 | 1335 | ||
| 97 | 스티모린에스크림10g | 1531 | ||
| 98 | 목앤스프레이 | 1353 | ||
| 99 | 라라올라액 20mL | 1492 | ||
| 100 | 트리싹200mg(10정) | 3515 | ||
| 전체보기 |
